

Salud
pH QUÉ ES y PARA qué SIRVE> DESCÚBRE LA VERDAD>>
pH Qué es y Para qué sirve – Suele suceder que en los productos de cosmética se menciona muy a menudo al pH y su calidad en la piel y el cuerpo. Así mismo en productos de limpieza e higiene personal, y en alimentación. Incluso hay dietas anticientíficas y muy populares, como la famosa dieta alcalina, que sostienen basarse en el concepto de pH.
pH Qué es y Para qué sirve

pH Qué es y Para que sirve – Descúbrelo – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve
pH es la sigla de Potencial de Hidrógeno iónico, es un indicador que mide la acidez, neutralidad o alcalinidad de un medio o disolución ya sea un cuerpo, una sustancia como el agua, una fruta o un alimento.
El Químico S. P. L. Sørensen introdujo la medición del pH
pH Qué es y Para qué sirve

Danes Soren Peter Lauritz Sørensen – pH Qué es y Para qué sirve – Introdujo la medición – pH Qué es y Para qué sirve
El concepto fue introducido por el químico Danes Soren Peter Lauritz Sørensen en 1909. La «P», que deriva del alemán potenz, que significa el poder de concentración, y la «H» es para el ión de hidrógeno (H+).
Se refiere a veces del latín pondus hydrogenii. El «p» equivale a la simétrico del logaritmo de base 10 de la actividad de los iones en las disoluciones a que se refiere, o sea:
pH = – log10 [H+] Aunque esto ya suena complicado.
pH Otros significados
La Fundación Carlsberg, sostiene que significa «poder de hidrógeno». Otra distinta explicación es que la P representa en términos latinos pondus hydrogenii «cantidad de hidrógeno» o potentia hydrogenii o capacidad de hidrógeno y también concentración de hidrógeno.
pH en Química
pH Qué es y Para qué sirve

pH Qué es en QUÍMICA – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve
Actualmente en química, la P significa cologaritmo decimal y también se usa en el término pKa, que se usa para las constantes de disociación ácida.
en que [H+] representa la concentración de iones H+ se expresa en mol/dm3.
Bueno muchos sostienen que para entender que es el PH debemos averiguar cual es el significado de ácido. Ya que el ácido lo hemos medido con respecto al gusto y el sabor, los más conocidos el limón con su ácido cítrico y el vinagre con su ácido acético.
El pH es una variable que mide el nivel de acidez de una sustancia
El ácido también afectan al mármol y reaccionan con algunos metales emanando gas hidrógeno. En 1663 El químico Robert Boyle hace más de 350 años llamó ácidos a estas sustancias con propiedades similares.
Lavoisier nombró el elemento químico de los ácidos
pH Qué es y Para qué sirve

pH Qué es y Para que sirve – Lavoisier – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve
En 1777 el químico francés Antoine Lavoisier supuso que todos los ácidos eran sustancias con un elemento químico a quien le puso por nombre oxigeno.
Y de dónde vino la palabra Oxigeno, pues fue formada por dos palabras griegas, oxys, acido, por el sabor punzante de las sustancias y genes, de creado o quien engendra, osea, oxys + genes resultó en oxigeno que quiere decir el creador o engendrado de ácidos.
Aunque muchos años después se descubrieron sustancias con propiedades ácidas que no tenían oxígeno en su composición. Un ejemplo es el ácido muriático o llamado también ácido clorhídrico, HCl que sirvió al químico del Reino Unido, Humphry Davy para concluir en 1810 que la acidez de las sustancias dependen del hidrógeno, y no como se creía del oxígeno.
Otro descubrimiento el químico Alemán, Justus von Liebig complementó la idea de Humphry Davy. En 1838 planteó la existencia de dos tipos de hidrógeno, siendo el hidrógeno que puede reemplazarse por metales el responsable de las propiedades de los ácidos.
En 1887 se planteó que el hidrógeno ácido era hidrógeno que se desglosaba de las sustancias ácidas como ion hidrógeno, y que se escribe H+ y popularmente llamado protón. Quien hizo este descubrimiento fue el químico Sueco Svante August Arrhenius.
Con esto se logró dar una definición más puntual sobre las bases. Arrhenius conjeturó que, si las bases neutralizaban a los ácidos sería porque contienen un ion de carga opuesta que da lugar a la formación de una sustancia que no es ni ácida ni básica, sino neutra. El creyó que ese ion sería el OH–, ya que al juntarse al H+ de los ácidos, llevaría a la formación de agua, osea H2O.
Aunque estas definiciones del químico sueco, Arrhenius para los ácidos y las bases son muy limitadas, en especial para las bases, pues no todas las sustancias de propiedades básicas contienen OH–, como por poner un ejemplo: el amoníaco, NH3. Aunque,, esta tesis estuvo vigente casi cuarenta años, en el que fueron apareciendo nuevas ideas y teorías que llevaron a conclusiones más perfectas.
En 1923 una teoría sobre los ácidos y las bases más completa surgió estas idea hoy es conocida como teoría ácido-base de Brönsted-Lowry. Lo que refiere es que los ácidos donan un protón (H+), y las bases las reciben, a esto se le llama como reacciones de transferencia de protones. El amoníaco (NH3), es una base pues es apto de captar H+ y constituir el ion amonio.
Reacciones de los ácidos
Asimismo, ahora se conoce que estas sustancias con sabor ácido manchan de rojo algunos pigmentos, como el tornasol que se sacan de algunos líquenes. Tradicionalmente se extrae de roccellas y dendrographas.
pH Qué es y Para qué sirve

Alcalis neutraliza el ácido – pH Qué es y Para qué sirve – Ácidos pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve
Álcalis Sustancia que neutraliza al ácido
Hay sustancias opuestas a los ácidos que en contacto con los ácidos amortiguan sus propiedades. Son de sabor amargo, que producen sensación jabonosa en la piel y tiñen de azul el tornasol. Álcalis del árabe al kali, que significa cenizas vegetales.
Al mezclar una sustancia ácida y otra alcalina se produce una sal que pierde las propiedades de ambas sustancias, después de esto también se llamó al álcalis base que deriva del griego basis, que es también el método para obtener sales.
¿pH qué es y cual es su escala ?
El carácter ácido de una solución está relacionado con la concentración de iones H+ presente en esta solución (cuanto más fuerte es un ácido, mayor es la concentración de estos iones en la solución).
La escala de pH es una forma de indicar la concentración de H+ en una solución.
Esta escala varía entre un valor mínimo de 0 (acidez máxima), y el máximo de 14 (acidez mínima o basicidade máxima).
A 25 ºC en una solución neutra o neutro tiene un valor de pH = 7.
pH Qué es y Para qué sirve

pH Qué es y Para qué sirve – efectos en el medio ambiente – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve
¿Para qué sirve la escala de pH?
Es una escala de valores que sirve para determinar y medir el grado de acidez o de basicidad de una determinada sustancia o producto. Varía entre 0 y 14, siendo el valor medio, el siete, correspondiente a soluciones neutras. Para valores superiores a 7 las soluciones son consideradas básicas, y para valores inferiores a 7, se ácidas.
medir productos disolución piel
¿Cómo se puede medir el valor de pH?
pH Qué es y Para qué sirve

pH Qué es y Para qué sirve – Medir – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve
El pH puede ser determinado usando un medidor de PH (también conocido como PHmetro) que consiste en un electrodo conectado a un potenciómetro. El medidor de PH es un milivoltímetro con una escala que convierte el valor de potencial del electrodo en unidades de PH. Este tipo de electrodo es conocido como electrodo de vidrio, que en realidad es un electrodo del tipo «ión selectivo».
El PH puede ser determinado indirectamente por la adición de un indicador de PH en la solución en análisis. El color del indicador varía según el PH de la solución. Indicadores comunes para medir son la solución alcohólica de fenolftaleína, el anaranjado de metilo y azul de tornasol.
Otro indicador de PH muy utilizado en los laboratorios es los llamados productos de papel de tornasol (papel de filtro impregnado con tornasol). Este indicador presenta una amplia gama de giro, que sirve para indicar si una solución es netamente ácida (cuando se pone rojo) o muy básica (cuando se pone en azul).
Se Utiliza todavía en gran escala, el papel indicador universal, que es una mezcla de indicadores de PH, normalmente en disolución o secos en tiras de papel absorbente, que presentan distintos colores para cada PH de 1 a 14.
Tablas con colores estándares del producto para los PH medidos son suministrados con las tiras, para que se pueda determinar el valor de PH, por comparación de la tabla con el color en la tira empapado en la solución a analizar.
Obs.: Aunque el valor del PH entienda un rango de 0 a 14 unidades, estos no son los límites para el PH. Es posible valores de PH por encima y por debajo de esta franja, como ejemplo, una solución que proporciona PH = -1,00, presenta matemáticamente -log [H+] = -1,00, o sea, [H+] = 10 mol L-1. Este es un valor de concentración fácilmente obtenido en una solución concentrada de un ácido fuerte como el HCl.
Sustancia PH
pH Qué es y Para qué sirve
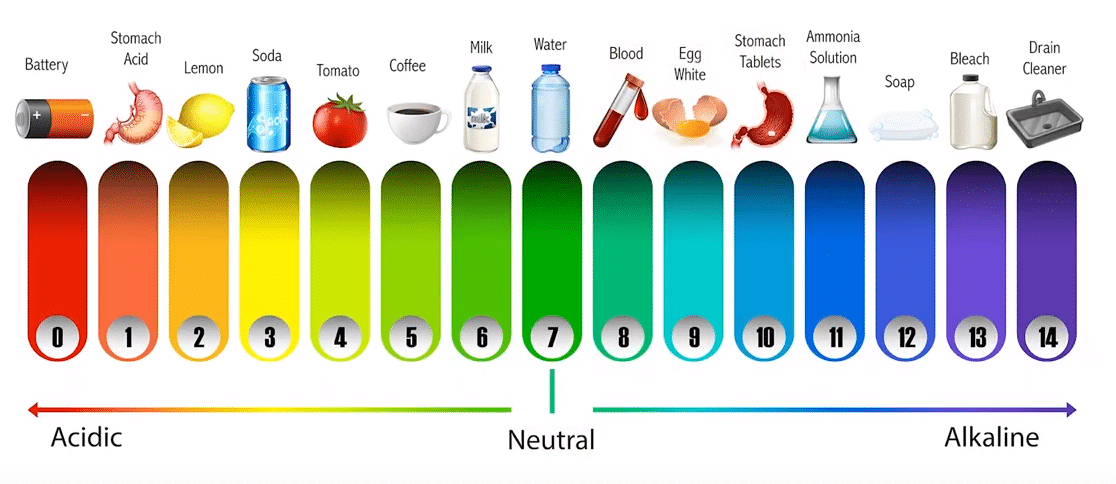
pH Qué es y Para qué sirve – Sustancias – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – Neutro – pH Qué es y Para qué sirve – Alcalino – pH Qué es y Para qué sirve
- Ácido de la batería < 1,0
- Jugo gástrico 1,0 – 3,0
- Zumo de limón 2,2 – 2,4
- Gaseosa tipo cola 2,5
- Vinagre 2,4-3,4
- Zumo de naranja o de manzana 3,5
- Cervezas 4,0 – 5,0
- Café 5,0
- Té 5,5
- Lluvia ácida < 5,6
- Leche 6,3 – 6,6
- Agua pura 7,0
- La Saliva humana 6,5 – 7,5
- La sangre humana 7,35 – 7,45
- El agua de mar 8,0
- Jabón 9,0 – 10,0
- Amoníaco 11,5
- «Lejía» 12,5
- Hidróxido de sodio (soda cáustica) 13,5
Seguro que también te interesa
- Palo Santo: Conozca sus propiedades curativas y terapéuticas
- 5 beneficios de la canela para la salud
- Plátano: ¿verde, amarillo o marrón? ¿Cual es mejor para la salud?
- Semilla de papaya para eliminar parásitos intestinales
Errores de medida con un medidor de pH (electrodo)
pH Qué es y Para qué sirve

pH Qué es y Para qué sirve – Medidor – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve
Hay varios tipos de errores que pueden ocurrir en las medidas del pH ocasionados por diversos factores, entre ellos, se destacan:
Errores de los estándares de calibración: Una medida de PH no puede presentar una precisión mayor que la de los estándares de referencia disponibles, presentando errores de la orden de ±0,01 unidades de PH.
Error del potencial de unión: Hay un potencial de unión en la membrana que separa el medio interno del externo del electrodo. Si la composición iónica entre estos diferentes medios (interno y externo) se presenta muy distante de la composición de la solución tampón estándar que se utiliza en la calibración del electrodo, el potencial de combinación es modificado, dando lugar a variaciones en las medidas de PH de alrededor de 0,01 unidades;
Error del desplazamiento del potencial de unión: La gran mayoría de los electrodos combinados tienen un electrodo de referencia de plata-cloruro de plata que contiene en su interior una solución saturada de KCl.
En vista de la alta concentración de iones cloruro en el interior del electrodo, esta permite, en contacto con el electrodo de plata, la formación de AgCl43 – y AgCl32-.
En la membrana porosa de vidrio del electrodo, que separa las soluciones interna y externa, la concentración de iones cloruro es menor (KCl está diluido), lo que favorece la precipitación de la Sal. Si la solución del analito medido contener un agente reductor, todavía puede ocurrir la precipitación de Ag(s) en la propia membrana. Estos efectos modifican el potencial de unión provocando un desplazamiento lento del valor de PH en la pantalla del instrumento durante un gran período de tiempo.
Tales errores pueden ser corregidos por la calibración del electrodo de cada 2 h.
Error de sodio (error alcalino): Cuando la concentración de iones H+ es baja y la concentración de Na+ es alta, el electrodo responde al Na+ como si este fuera el H+ y el PH medido se convierte menor que el PH verdadero.
Error ácido: En ácidos fuertes, el valor del PH medido se hace más grande que el PH verdadero, debido a la saturación de iones H+ en la superficie de la membrana de vidrio del electrodo. Esto se produce debido a la saturación de los sitios activos de la membrana de vidrio del electrodo.
Error en el tiempo para alcanzar el equilibrio: Las medidas de PH generalmente se obtienen después de algún tiempo de contacto del electrodo con la solución de interés. Una solución bien tamponada, bajo agitación adecuada, este tiempo de espera es de alrededor de 30 segundos. Una solución mal tamponada (por ejemplo, cercana al punto de equivalencia de una titulación) necesita de un mayor tiempo para alcanzar el equilibrio.
Error de hidratación del vidrio: Un electrodo hidratado presenta una respuesta adecuada a las variaciones de PH, mientras que un electrodo seco, necesita ser hidratado durante varias horas antes de que se realice una medida.
Error de temperatura: Las mediciones de PH necesariamente deben ser realizadas en la misma temperatura en la que se produjo su calibración.
¿Por que debemos tener un pH adecuado?
pH Qué es y Para qué sirve

pH Qué es y Para qué sirve – Adecuado – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve
El punto es quién mide la acidez y la alcalinidad es el PH. El ser humano trabaja en un PH que está catalogado debe estar entre 7.35 y 7.45. Hay unos pocos alimentos que disminuimos generalmente ese estado ideal de nuestro PH y hay mucha charla que el cuerpo debe ser alcalino y no ácido.
Para darte una idea de la peor acidez es la muerte. Cuando morimos, el corazón deja de latir, los órganos fallan en hacer sus funciones y el cuerpo se vuelve ácido. En esa acidez comienzan a crecer las bacterias que tenemos dentro de nuestro cuerpo, los gusanos, y hay podredumbre y destruir los organismos. Esto ayuda a la sociedad a la que los cuerpos no están por ahí enteros. Es un proceso de vida, la acidez es un proceso evolutivo de enfermedades»
En acidez las enfermedades se proliferan y en alcalinos las enfermedades están ausentes. Alguno médicos aseguran que este tal vez sea la diferencia entre estar sano y enfermo, tener un PH acido o tener un PH alcalino
El cloro y el pH qué es en las piscinas
pH Qué es y Para qué sirve

pH Qué es y Para qué sirve – Piscinas – pH Qué es y Para qué sirve – Cloro – pH Qué es y Para qué sirve – pH Qué es y Para qué sirve
Tomemos en cuenta que en aguas con un pH alto, la mayoría de este ácido (cloro activo) se convierte en ión hipoclorito (ClO-), una manera de cloro con muy bajo poder desinfectante. Se recomienda que el pH se mantenga entre 7,2 y 7,8.
pH qué es – Video
pH Qué es y Para qué sirve
El pH Qué es y Para qué sirve.
-

 Apps de películas6 días ago
Apps de películas6 días ago11 App para Ver Películas y Series gratis en Español latino ◀︎
-

 Apps de películas1 día ago
Apps de películas1 día ago17 Aplicación para ver Películas de Estreno Gratis 2025 ▶︎
-

 Apps de películas1 día ago
Apps de películas1 día agoMejores aplicaciones para ver Películas y series gratis 2024
-

 Ver películas online3 días ago
Ver películas online3 días ago25 Páginas Para Ver Series Gratis Online en Español 🍿





















![Peligra CUSCO alerta experto Mundial en Explosivos [VIDEO] 163](https://pysnnoticias.com/wp-content/uploads/2021/10/MINIATURA-CASO-CUSCO-80x80.png)





















